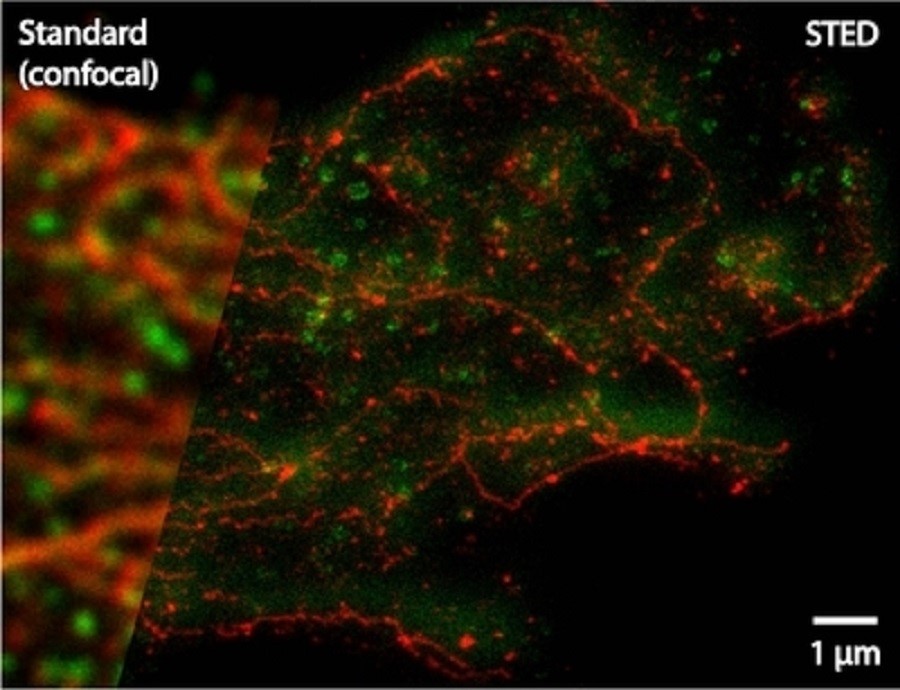
Zwei-Farben-STED-Aufnahme des häufigsten bösartigen Hirntumors bei Erwachsenen. Im Gegensatz zum verschwommenen klassischen Bild (links) zeigt das STED-Bild (rechts) feinere Strukturen. Fotos: Max-Planck-Insitut für biophysikalische Chemie
Deutschland bekommt den Chemie-Nobelpreis 2014 – oder vielmehr ein Mann aus Deutschland. Der Mikroskop-Forscher Stefan Hell hat mit zwei amerikanischen Kollegen die Grenzen der Physik überwunden und die medizinische Forschung revolutioniert. Nobelpreiswürdig.
2014 ist unser Jahr, wir sind Fußball-Weltmeister und nun auch Nobelpreisträger. Jedenfalls zu einem Drittel. Stefan Hell ist seit 2002 Direktor des Max-Planck-Instituts für Biophysikalische Chemie in Göttingen. Zusammen mit William Moerner und Eric Betzig aus den Vereinigten Staaten hat er am 10. Dezember die begehrte Auszeichnung von der Schwedischen Akademie der Wissenschaften erhalten. Für ein Mikroskop, das die (bisherigen) Grenzen der Physik überschreitet.
Das Verfahren, das die drei Forscher dafür entwickelten, nennt sich Stimulated Emission Depletion (STED) und wird bei sogenannten Fluoreszenzmikroskopen verwendet.
Das Bild heranzoomen
Fluoreszenzmikroskope sind eine bestimmte Art von Lichtmikroskopen. Im Prinzip „beschießen“ sie das zu untersuchende Teilchen mit einem Lichtstrahl einer bestimmten Wellenlänge. Das Teilchen gewinnt durch das Licht an Energie und kann den Lichtstrahl reflektieren – in einer anderen Wellenlänge. Ein blauer Lichtstrahl wird so zum Beispiel als grüner Lichtstrahl zurückgestrahlt, da die Wellenlänge die Lichtfarbe beeinflusst: Das Teilchen fluoresziert.

So freut sich ein Nobelpreisträger: Stefan Hell forscht seit über 20 Jahren an dem Mikroskopier-Verfahren.
Stefan Hell und seine Kollegen veränderten dieses Verfahren: Statt einem Laserstrahl setzten sie zwei ein. Der zweite Laser „filtert“ einzelne Nanopartikel aus dem Lichtstrahl, der vom fluoreszierenden Teilchen zurückgestrahlt wird. Durch das STED-Verfahren kann das Bild des Fluoreszenzmikroskops quasi heran gezoomt werden, bis zu einer Auflösung von 2,4 Nanometern im Durchmesser. Das Besondere daran: In der Forschungswelt war man sich eigentlich seit knapp 150 Jahren einig, dass die Auflösung eines Lichtmikroskops von 200 Nanometern nicht unterschritten werden kann – die sogenannte Beugungsgrenze.
Mit STED lassen sich extrem kleine Objekte untersuchen, denn ein Nanometer entspricht einem Millionstel Millimeter: In Zahlen dargestellt sind das 0,000000001 Meter. In dieser Größenordnung kommen verschiedene Moleküle im menschlichen Körper vor. Zum Beispiel das Protein p53, ein Protein, das die Entstehung von Krebs verhindert – wenn es gesund ist und richtig arbeitet. Beispielsweise durch den Einfluss von Viren kann es aber sein, dass das Protein mutiert und seine Funktionsweise verändert: Das mutierte p53 tötet Krebszellen nicht ab, sondern fördert ihre Entstehung. Mit dem STED-Verfahren könnten Forscher diesen Vorgang genauer untersuchen und damit bedeutende Fortschritte in der Krebsforschung bewirken. Denn das p53-Protein ist nur wenige Nanometer „groß“ und damit zu klein für andere Mikroskope.
Ein wissenschaftlicher Durchbruch
Außerdem kann ein STED-Mikroskop das Molekül in seiner dreidimensionalen Form und „live“ – also in Echtzeit – darstellen und zeigt außerdem die Vorgänge im Molekül, weiß Dr. Martin Masip, Forscher am Max-Planck-Institut für Molekulare Physiologie in Dortmund.
Bei seiner Forschungsarbeit beschäftigt er sich vor allem mit der Entwicklung und Anwendung von Mikroskopier-Techniken. „Das STED-Verfahren ist ein wissenschaftlicher Durchbruch, darüber gibt es keine Zweifel“, sagt er. Es erlaube die Betrachtung kleinster, lebendiger Objekte, live und in Farbe – eine Kombination, die in dieser Art von keinem anderen Mikroskop geleistet werden könne.
„Zukünftig wird das auch in der regenerativen Medizin und in der Stammzellen-Forschung eine wichtige Rolle spielen“, prophezeit er. Dass es für dieses revolutionäre Verfahren den Nobelpreis gibt, war für ihn keine Überraschung. „In Fachkreisen überlegten wir schon seit längerem, wann die Nobelstiftung Hell & Co. endlich auszeichnen würde. Ich hätte allerdings nicht damit gerechnet, dass es der Preis in der Chemie ist, sondern in der Physik.“
Wie genau Mikroskope funktionieren und welche Neuerungen das STED-Mikroskop bringt, veranschaulicht das Forschungsinstitut von Stefan Hell in diesem Video.


1 Comment